QUAL O LIMITE SEGURO PARA CLORETOS? E PARA SISTEMAS COM AÇO INOXIDÁVEL?
Esse é um problema crítico em sistemas de resfriamento, principalmente quando se tem aço inoxidável e que gera muitas dúvidas e preocupações.
Quando existem equipamentos de aço inox 304/316, a concentração máxima de cloretos deve ser aquela especificada pelo fabricante do equipamento. Outra opção, é definir um limite considerando a criticidade e o histórico do sistema. Normalmente, o limite deve ser <300 ppm.
Os íons cloretos e sulfatos elevam significativamente a agressividade da água, com forte tendência à corrosão por pites em aço inox e assim, deve ser especificado um limite para a somatório das concentrações de cloretos (Cl–) e sulfatos (SO4–). A prática tem demonstrado que é possível a operação de sistemas de resfriamento com inibição satisfatória à corrosão por pites com programa de tratamento adequado e limite das concentrações de cloretos + sulfatos < 500 ppm.
Temos um caso real, com inox 304 e 316, operando há mais de 40 anos com teores médios de cloretos e sulfatos no make up de 160 ppm de 80 ppm respectivamente e com ciclo de 4. Assim, temos 640 ppm e 320 ppm com total de 960 ppm sem evidência de corrosão. Outros sistemas operam com >2.000 ppm de cloretos também sem evidências de corrosão. Por lado, sistemas com concentração de cloretos <100 ppm sofreu perda total do trocador de calor com menos de 1 ano de operação.
Se seguirmos a orientação da literatura ou do fabricante, muitas vezes conservador em função de garantias dos equipamentos, teríamos de desativar a fábrica.
Leia também: 2a turma – CURSO “Tratamento de Águas de Resfriamento” será transmitido on-line AO VIVO, dia: 12.12.2023
Confira a ementa completa >>
ENTÃO QUAL É A SOLUÇÃO?
1- SEMPRE, que possível, seguir a orientação do fabricante do sistema, mas que muitas vezes fornece um equipamento sem verificar a qualidade da água.
2- Outros fatores devem também ser considerados, tais como: make up; temperatura; condutividade; tipo de inox; áreas de soldas, as principalmente, o HISTÓRICO DO SISTEMA, observando se já houve relatos de corrosão por cloretos; concentração de operação; tipo de tratamento utilizado; monitorar as taxas de corrosão, deposição e de pitting; etc.
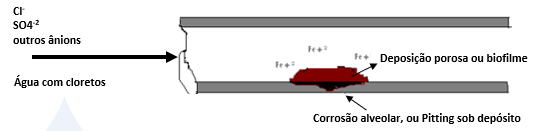
A célula de corrosão em aço inoxidável pode ser ilustrada conforme esquema abaixo:
Reações:
H2O + ½O2 <==> 2Fe2O3 . nH2O
- Feº <==> Fe+² + 2e– (oxidação/anodo)
- H²O + ½O2 + 2e– <==> 2(OH)– (redução/catodo)
Na reação completa: Feº + ½O2 + H2O <==> Fe(OH)2 que reagirá com:
H2O + ½O2 <==> 2Fe(OH)3 que continuará a reação com:
H2O + ½O2 <==> 2Fe2O3 . nH2O
Na deficiência de O2 haverá formação de Fe3O4 (magnetita) e na presença de O2 haverá formação de 3Fe2O3 (hematita) . nH2O.
Na região com menor aeração e com a formação do Fe2O3 . nH²O entre os cristais pode haver uma super pressão equivalente a 4.700 psi, fraturando a liga e concreto, revestimentos, etc..). Este é uma das principais causas de trincas e pode ser ainda mais crítico com a formação de H² e/ou CH4 no interior dos cristais.
Com a oxidação do Fe++ sob o depósito na zona anódica, existe uma grande formação de célula positiva, que provoca um grande fluxo de cargas negativas (Cl–, SO4-2, etc.) visando equilibrar a reação e quando aparece o íon cloreto (Cl–) no interior do depósito, ele será mais eletronegativo que o (OH)–, fazendo com que a reação acima não forme o Fe(OH)2 mas sim o cloreto de ferro II, pois todo cloreto é solúvel e é cíclico, ou seja: forma o cloreto que se hidrolisa e que volta a formar mais cloreto que formará mais ácido e assim por diante, enquanto que o pH sob o depósito será <2, como mostrado nas reações de hidrólise abaixo:
FeCl2 + 2H2O ==> Fe(OH)2 + 2 HCl (pH < 2) ==> Feº + 2HCl ==> FeCl2 + H2 (cíclico), onde este H2 irá migrar também e causando mais danos à liga, como exemplo, a fragilização por hidrogênio,
ou
FeCl3 + 3H2O ==> Fe(OH)2 + 3HCL ou 2FeCl3 + 3H2O ==> Fe2O3 + 6HCl (pH <2)
e a mesma reação para o filme de Cromo:
Cr3Cl3 + 3H2O ==> Cr(OH)3 + 3HCl
A pilha fica cada vez mais positiva com o Fe+², Fe+³ e Cr+³
O O2, por ter solubilidade praticamente nula em soluções muito salinas, não haverá a formação de Fe(OH)2 e sim:
2H+ + 2e- => H2
e este, por sua vez, irá decapar todos os óxidos metálicos de passivação de cada camada (grão) até furar o tubo, ou trincar via a formação do Fe2O3 . n.H20 que tem uma fortíssima pressão em sua formação (isto ocorre mais em menores temperaturas, ao invés da formação do metano que exige altas temperaturas e pressão), conforme a reação abaixo:
Fe3O4 + 8H+ ==> Fe+² + 2Fe+³ + 4H2O
Desta forma, a haverá a decapagem total do filme protetor corroendo todo o ferro sob depósito, da mesma forma para Feº (metálico):
Fe0 + 2H+ ==> Fe+² + H2
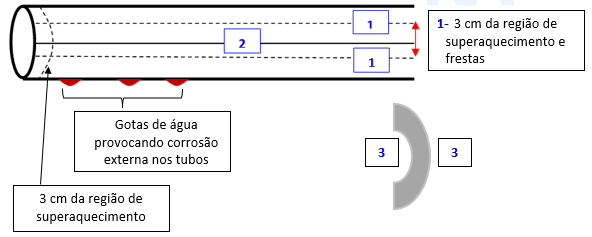
O problema de super aquecimento no aço inox no momento da soldagem dos tubos, pode ocorrer as seguintes consequências:
A reação da formação de 2(OH)– pode ocorrer em meio neutro aerado e não aerado também.
Mas a reação do 2H+ + ½O2 + 2e- ==> H2O em meio ácido aerado e o 2H+ + 2e- ==> H2. Este H+ no estado atômico, poderá formar hidrocarbonetos voláteis, onde o mesmo reage com a cementita (Fe3C (ou carbeto ou carboneto de ferro) formando o gás metano (CH4). Tal formação é brusca e com elevadíssima pressão, causando trincas e empolamentos pelo Hidrogênio na liga, que é mais comum em situações de elevada pressão e temperatura, através da seguinte reação: Fe3C + 2H2 ==> 3 Fe + CH4
FATORES PROVÁVEIS DA CORROSÃO POR CÉLULAS DE CLORETOS EM INÓX:
- DEPOSIÇÃO – Nunca poderá haver a presença de deposição porosa, pois está provado que sob uma pilha como citado acima, a concentração de cloretos poderá chegar à níveis de 4.000 ppm ou mais, independentemente da quantidade de cloretos que se tenha na água de recirculação. A velocidade da reação poderá ser maior ou menor, mas o teor final no longo do tempo será sempre o mesmo para equilibrar sempre as cargas.
- TEMPERATURA – Deverá ser a menor possível. A temperatura próxima à temperatura ambiente seria a ideal e nunca >60 ºC.
- pH – O ideal seria operação com LSI o mais próximo possível de zero na escala de Langelier.
- SOLDAS – Esse fator requer todo cuidado possível, pois poderá ocorrer corrosão severa por pittings nos 3 cm ao redor da linha de soldagem, conforme mostrado no esquema acima.
- PRESENÇA DE FRESTAS – Nas frestas é onde pode acumular sólidos suspensos e consequentemente, onde haverá a formação de pilha de aeração diferencial conforme reações acima.
- ÁREAS DE TENSÕES NA FABRICAÇÃO – As regiões de curvas (3), principalmente onde os cristais estão comprimidos e ou esticados, são muito sensíveis, pois a mínima corrosão poderá provocar trincas.
- TIPO DE AÇO INOX – Deve ser considerado a ação mecânica de velocidade; vibração; concentração de sólidos suspensos na água solução; etc.
Resistência: 304 COM costura << 304 SEM costura << 316 L COM costura << 316 L SEM costura
- TEOR DE CLORETOS – Conforme detalhado anteriormente, o íon cloreto tenderá a ficar sob esses depósitos, se concentrando 10, 20 ou mais vezes sua concentração presente na água de recirculação. Esse é um dos motivos de ser muito difícil se estabelecer um limite seguro de concentração de cloretos em águas, sendo assim, QUANTO MENOR MELHOR.
Fonte: José Luiz Brunhara
Saiba tudo sobre Caldeiras de Baixa e Média Pressão – Curso EAD

Carga horária: 08 Horas
Material Incluso: Apostila em .pdf, Planilhas de cálculos, Avaliação e Certificado.
CLIQUE NA IMAGEM ACIMA e confira a EMENTA COMPLETA
DOWNLOAD: RESUMO DA APOSTILA SOBRE CALDEIRAS
>> BAIXE AGORA MESMO <<
Tem interesse em adquirir a(s) APOSTILAS COMPLETA sobre Águas de Caldeiras e Torres de Resfriamento?
Entre em contato: juliana@digitalwater.com.br e confira os valores.